Se deixarmos uma garrafa de água cheia no congelador, ela rebenta.
Isto acontece, porque o gelo é menos denso do que a água.
Assim, uma mesma massa de gelo ocupa mais volume do que uma mesma massa de água.
domingo, 12 de dezembro de 2010
terça-feira, 7 de dezembro de 2010
Notação de Lewis

 Uma estrutura de Lewis é constituída pelo símbolo de um elemento rodeado por um ponto por cada electrão de valência presente no átomo desse elemento.
Uma estrutura de Lewis é constituída pelo símbolo de um elemento rodeado por um ponto por cada electrão de valência presente no átomo desse elemento.A ligação entre dois átomos de hidrogénio, forma uma molécula de hidrogénio.
Ligação química (ligação covalente)
A ligação covalente forma-se pela partilha de electrões de ambos os átomos nela envolvidos.
A ligação covalente pode ser:
Simples – partilha de dois electrões (um par);
Dupla – partilha de quatro electrões (dois pares);
Tripla – partilha de seis electrões (três pares);
Tabela Periódica dos Elementos
A tabela periódica esta dividida em três grandes grupos:
Metais - Zonas assinaladas pelas cores verde, azul e roxo.
Semi-metais - Zona assinalada pela cor lilás.
Não-metais - Zona assinalada pelos tons de cor-de-rosa.
Esta tabela também está divida em famílias:
Grupo 1 - Família dos Metais Alcalinos
Grupo 2 - Família dos Metais Alcalino-Terrosos
Grupo 17 - Família dos Halogéneos
Grupo 18 - Família dos Gases Nobres ou Raros
Os grupos da tabela periódica também são divididos em dois grupos:
Grupos 1,2,13,14,15,16,17,18 - elementos representativos
Grupos 3,4,5,6,7,8,9,10,11,12 - elementos de transição
O número dos electrões de valência está associado ao número do grupo (nos elementos representativos), ou seja é igual. O número de níveis de energia está relacionado com o número do período em que o elemento se encontra.
A tabela periódica tem 18 grupos e 7 períodos.
sábado, 4 de dezembro de 2010
Importância dos isótopos no dia-a-dia
Os isótopos têm elevada importância na nossa vida embora não nos apercebamos disso. Têm grande utilidade na indústria, medicina e outras áreas.
Por exemplo: O Carbono 11 é usado no exame PET em medicina nuclear que permite observar o estado fisiológico dos tecidos de forma não invasiva. O carbono 14 é usado na datação radiométrica que serve para calcular a idade absoluta de uma rocha e dos minerais que contém certos isótopos radioativos.
Por exemplo: O Carbono 11 é usado no exame PET em medicina nuclear que permite observar o estado fisiológico dos tecidos de forma não invasiva. O carbono 14 é usado na datação radiométrica que serve para calcular a idade absoluta de uma rocha e dos minerais que contém certos isótopos radioativos.
Modelos Atómicos
Modelo atómico de Dalton:
-Tudo que existe na natureza é composto por diminutas partículas -denominadas átomos.
-Os átomos são indivisíveis e indestrutíveis.
-Cada elemento químico apresenta diferentes características (tamanho, peso).
-Modelo simples.
Modelo atómico de Thomson:

-"Modelo do Pudim de Passas".
-Descoberta do electrão.
-Os átomos eras corpúsculos de carga positiva onde se encontravam dispersos electrões, com carga negativa, un número suficiente para a carga global ser nula.
Modelo atómico de Rutherford:
-O átomo é constituído por um núcleo central positivo, muito pequeno em relação ao tamanho total do átomo.
-No núcleo concentra-se toda a massa do átomo.
-Os electrões movem-se em volta do núcleo.

Modelo atómico de Bohr:
-Os electrões movem-se à volta do núcleo em orbitas circulares.
-A cada órbita é atribuído um determinado valor de energia.
-O estado fundamental corresponde ao estado de menor energia
Modelo atómico da nuvem electrónica:
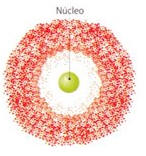
- Os electrões do átomo movem-se de modo desconhecido, formando uma espécie de nuvem que não é uniforme: nuvem electrónica
- A nuvem electrónica é mais densa próximo do núcleo, onde é mais provável encontrar os electrões.
- Modelo atómico actual.
-Tudo que existe na natureza é composto por diminutas partículas -denominadas átomos.
-Os átomos são indivisíveis e indestrutíveis.
-Cada elemento químico apresenta diferentes características (tamanho, peso).
-Modelo simples.
Modelo atómico de Thomson:

-"Modelo do Pudim de Passas".
-Descoberta do electrão.
-Os átomos eras corpúsculos de carga positiva onde se encontravam dispersos electrões, com carga negativa, un número suficiente para a carga global ser nula.
Modelo atómico de Rutherford:
-O átomo é constituído por um núcleo central positivo, muito pequeno em relação ao tamanho total do átomo.
-No núcleo concentra-se toda a massa do átomo.
-Os electrões movem-se em volta do núcleo.

Modelo atómico de Bohr:
-Os electrões movem-se à volta do núcleo em orbitas circulares.
-A cada órbita é atribuído um determinado valor de energia.
-O estado fundamental corresponde ao estado de menor energia
Modelo atómico da nuvem electrónica:

- Os electrões do átomo movem-se de modo desconhecido, formando uma espécie de nuvem que não é uniforme: nuvem electrónica
- A nuvem electrónica é mais densa próximo do núcleo, onde é mais provável encontrar os electrões.
- Modelo atómico actual.
Subscrever:
Mensagens (Atom)



